21世纪经济报说念记者武瑛港 实习生马瑜欣 北京报说念 “中国临床缠绵质地和监管体系皆达到了寰球率先水平,中国临床缠绵的速率和评价体系也达到了寰球率先水平。”近日,中国医学科学院肿瘤病院副院长李宁讲解在“临床缠绵大查房”栏目中暗示。
www.crownsportssitezone.com说明李宁讲解梳理的各方面数据分析,目下中国临床试验机构的质地跨越好意思国、韩国、英国等推崇国度,仅次于日本,并且和好意思国比拟,中国对临床试验的核查频率更高、核查力度也更大。
在昔时10年,中国企业发起的公共多中心临床试验参与率增速高达15.7%,远高于韩国的8.2%和日本的6.8%。2021年,中国企业发起的公共多中心临床试验参与率已跨越日本和韩国。
欧洲杯赛程比赛场地另外从临床期骗情况来看,李宁讲解进一步指出,中国临床试验的落拓得到了鄙俚招供,2016-2023上半年,中国药企开拓并获批上市的抗肿瘤新药以为62种,其中有37种新药被纳入2022版CSCO指南推选使用,占比59.7%,有15种新药被2023版NCCN指南接纳并推选期骗,占比24.2%。
博彩真人娱乐场官网中国临床试验机构质地达到寰球率先水平
据了解,在公共鸿沟内,但凡向FDA央求药物在好意思国上市的厂家及奉行临床试验的缠绵中心和PI,皆有拖累和义务接受FDA的核查,核查落拓一般分为三类:NAI,迷漫莫得问题,不需要采用行政门径;VAI,轻浅造作,(企业或机构)自发采用行政门径;OAI,(FDA)需要采用官方行政门径。
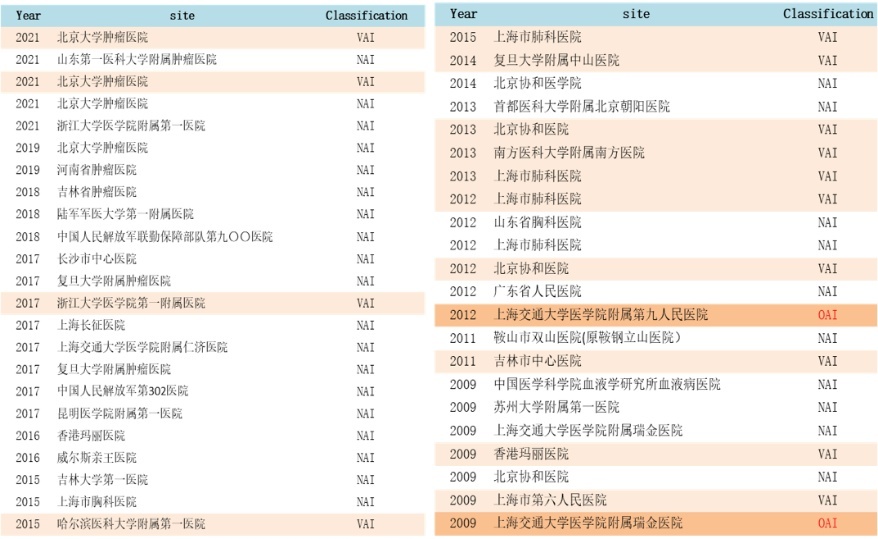
说明李宁讲解梳理,从2005年至2023年,中国共接受FDA的45次核查,其中29次为NAI,无造作通过,占比65%,14次VAI,占比31%,独一2009年和2012年2次是OAI,均在2015年“722”事件之前。
“722”事件原指CFDA于2015年7月22日发布的《对于开展药物临床试验数据自查核查责任的公告》(2015年第117号)。公告使用了“最严谨的圭表、最严格的监管、最严厉的处罚、最严肃的问责”当作条款,堪称“史上最严的数据核查条款”。最终触及的1622个自查央求中,跨越80%的禀报材料企业主动撤退。
皇冠体育hg86a
皇冠客服飞机:@seo3687网站提供安全、稳定的博彩平台和专业的博彩攻略和技巧分享,同时还有多样化的博彩游戏和赛事直播,让广大博彩爱好者能够在博彩游戏中尽情享受博彩乐趣。开首:国度癌症中心/医科院肿瘤病院GCP中心
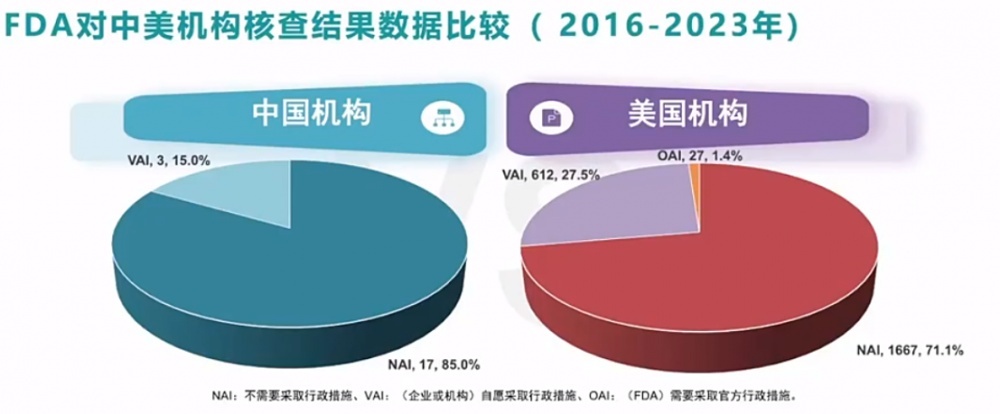
幸运快艇彩票网从FDA的核查数据中不错发现,目下中国临床试验机构的质地达到寰球率先水平。
说明2016年-2023年FDA对中好意思机构核查落拓的数据比较,同期稽查落拓中,FDA共核查中国机构20次,零次0AI落拓出现,低于好意思国的1.4%;不需要采用行政门径(NAI) 落拓比例为85.0%,高于好意思国机构的71.1%;发现问题,自发采用门径(VAI) 落拓比例为15.0%,低于好意思国机构的27.5%。
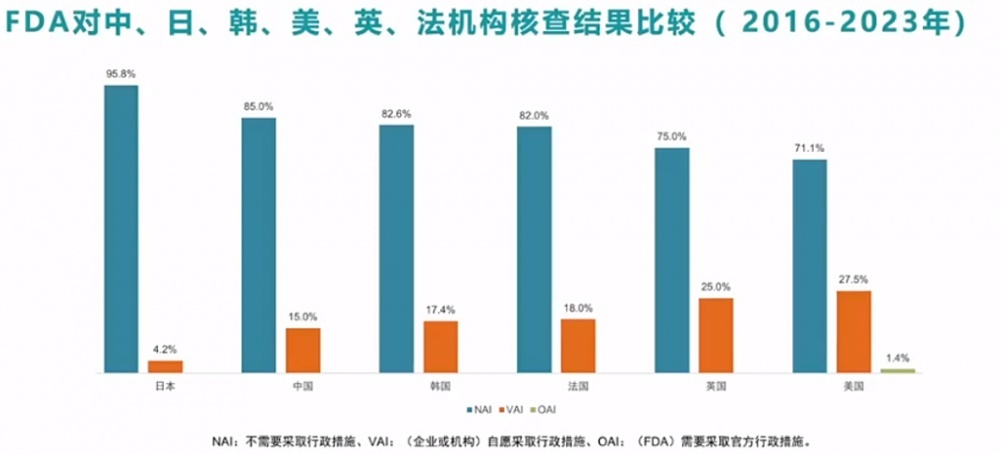
另外与日、韩、英、法等机构核查落拓对比发现,临床缠绵质地最高的是日本,中国排第二,优于韩国、法国、英国,好意思国排临了。

开首:国度癌症中心/医科院肿瘤病院GCP中心
“通过数据图表不错很直不雅地看到中国的临床缠绵质地过硬,是有上风的,若是中国再多接受几次核查,在扩大样本量的基础上仍能保抓这一圭表,那么临床试验质地可能会显耀高于好意思国。”李宁讲解指出。
还值得关怀的是,据李宁讲解进一步分析,中国大多量被FDA核查的病院并非国度级医学中心,而是北京、浙江、上海、广东、山东、吉林等各省级和市级肿瘤病院或空洞病院,这些现场核查的落拓也充分代表了中国临床缠绵的宽绰、平均水平,得当FDA国外圭表的基本条款。
除了临床缠绵质地,据先容,临床缠绵质地体系是缠绵质地的基本保险,中国的这一体系也达到了寰球率先水平。
李宁讲解暗示,“722”事件之后,中国临床试验质地监管体系与国外全面接轨,并圭表各式条款。与FDA、EMA(欧洲药品管束局)和PMDA(日本药品医疗器械管束局)比拟,缠绵圭表疏通(ICH E6R2)、核核对象基本疏通、核查关怀的点也基本疏通。为了保证核查质地,在具体管束轨制和笃定上,中国核查甚而会愈加严格。举例除惯例稽查、有因稽查外,我国还有针对机构层面的普通稽查,稽查维度更多,密度更大;我国的核查戎行也比FDA、EMA和PMDA更为复杂,核查构成员除了临床缠绵的各人,还包括同鸿沟的各人,并且可能会有多支核查团队同期进行核查责任。
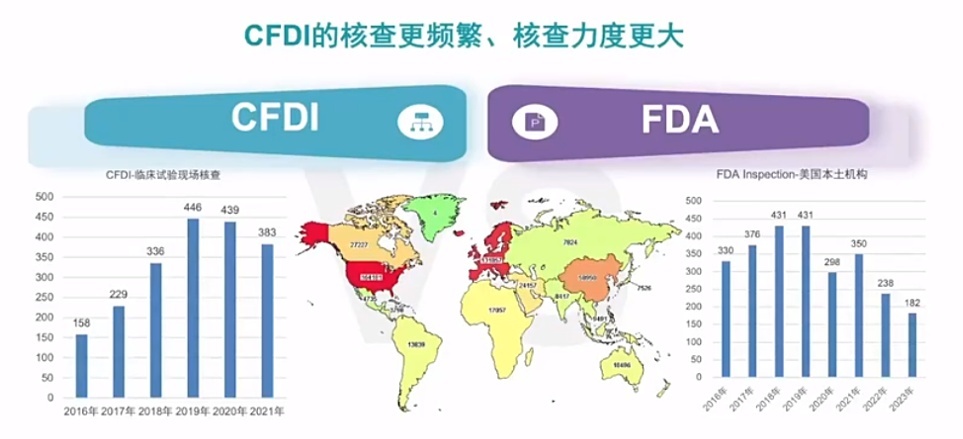
说明Clinical trials登记,好意思国临床试验数目远高于中国 (164181vs31068),在临床试验数目悬殊稠密的情况下,中国国度药品监督管束局食物药品审核查抄中心(CFDI)临床试验现场核查频率仍不低于好意思国,由此可见中国对临床试验的核查频率更高、核查力度也更大。
开首:国度癌症中心/医科院肿瘤病院GCP中心
另外中国临床缠绵的速率和评价体系也达到了寰球率先水平。
说明李宁讲解分享的数据分析,昔时10年内,中国有100种抗肿瘤新药见效上市,经由了临床试验的锤真金不怕火,0撤市;而FDA自2011年到2023年,批准118个新药,恰当症约400个,抗肿瘤新药审批上市后撤市的一共26个恰当症。
被行业热议的PD-1/PD-L1药品,经由药监严格的审核后,中国获批上市的独一9款,远小于投入临床试验阶段的数目。获批的药物均被纳入CSCO肿瘤临床调整指南,有4个被纳入医保,临床价值获鄙俚招供。且国产PD-1/PD-L1药物价钱远低于入口药,性价比和可及性更高,造福中国患者。
皇冠篮球走地比分“此外,越来越多的中国新药,比如泽布替尼、西达基奥仑赛等,以中国的临床缠绵数据见效赢得FDA的上市批准;另一方面,中国参与公共企业开展的多区域多中心临床缠绵增速高达15.7%,远超西洋日韩等地区,这象征着公共企业对中国临床试验质地用脚投票,充满信心。同期中国的入组速率、运营效劳等也不逊于国外同业。”李宁讲解强调。
质地追求无上限
皇冠abc盘水位是多少中国临床缠绵在速率、质地和才略多方面赞助后,达到了寰球率先水平,李宁讲解强调这并非某一方的业绩,而是包括监管方、申办方、PI、缠绵医师、缠绵照看、缠绵药师、CRC、CRA等在内的统共这个词团队的共同奋勉。
“中国临床缠绵质地、中国临床缠绵质地监管体系、中国临床缠绵的速率和评价体系已达寰球率先水平,中国临研东说念主不错为之自重。但咱们也应该意识到,对于临床缠绵质地的追求是无上限的。”李宁讲解指出。

诚然从2016年-2023年的FDA核查落拓来看,中国临床缠绵质地跨越了部分国度,然则李宁讲解强调,中国距离第别称日本仍有差距,距离金圭表也有一定差距,何况金圭表一直处在变化之中,并且哪怕达到了金圭表也仍有发展空间——距离理念念还有差距。“咱们知说念目的是什么、知说念绝顶在何处、知说念目下在那里、知说念差距在什么地点,也就知说念了蜕变的想法。追求高了,不是赖事。”
那么该若何进一步提高中国临床缠绵的质地?
李宁讲解指出,要作念好临床缠绵团队的开拓,团队成员各尽其职,追债有主。“临床缠绵团队中不啻有医师团队,还包括药师、照看、临床缠绵助理CRC等, 医师团队需要作念好发药、领药等责任,照看团队需要作念好单采、血管成像等责任,临床缠绵助理CRC需要作念好协助医师等责任。术业有专攻,要尊重专科、尊重付出,团队里的每个东说念主皆在领悟紧迫作用。”
然则组建专职缠绵团队并非易事,据李宁讲解分析,在团队中明确PI的职责是提高临床研发质地的重要门径。举例也曾备受关怀的ICH E6(R3)带领原则,念念传达的含义即缠绵者是团队,而非个东说念主,临床试验是团队的职责,而非个东说念主的职责,缠绵者杰出于团队的法东说念主,“见效他受益,拖累他来担”。
除此以外,李宁讲解还告诉21世纪经济报说念,其实团队组建的最难点在于利益分派,每个东说念主相应的处事和付出需要有相应的成绩,独一科罚这一问题,其他方面才略理顺,“这里需要强调PI和临床缠绵团队的引导要有分享和服务的精神,要将成绩的效果合理分派给统共这个词团队,切忌独占独拿。”
李宁讲解进一步暗示,组建好意思满体系的团队并非科主任个东说念主能胜任,科主任大略灵验调换科室的医师,然则对督察团队的调换权限相对有限,对药师、影像、病理等团队的调换力可能会更弱,组建团队相等不易。
“还但愿一个团队大略将缠绵者的脑力、工夫、元气心灵留出来作念科学方面的判断,把其他事务性责任交给平台,其实PI能作念好团队组织和科学性责任就也曾很了不得了,要让合适的东说念骨干合适的事情。”李宁讲解告诉21世纪经济报说念。
除了团队组建,科学监管也十分紧迫。李宁讲解强调,独一处罚力度远高于作秀获益,才略极大减少出现作秀,“在我看来,数据是奋勉作念出来的,但要按照限定去作念,而限定是查出来的,独一查了才知说念有莫得守限定,然则质地是罚出来的,不错是罚钱,也不错是罚名,即公开指明是谁莫得达到质条款,是谁在弄虚不实,正如‘法莫如显,使民知之。’”
(剪辑:徐旭)2024年太阳城娱乐轮盘